
첫 번째 단서 : 공유결합
원자는 (+)전하를 띠는 원자핵과 ()전하를 띠는 전자를 갖는다. 산소 원자는 전자를 8개 갖고 있다. 원자는 전자의 개수에 따라 껍질 한 개를 갖기도 하고, 여러 개를 갖기도 한다. 첫 번째 껍질의 최대 전자 수는 2개다. 두 번째 껍질의 최대 전자 수는 8개이다. 자연히 산소 원자는 첫째 껍질엔 2개, 둘째 껍질엔 6개의 전자를 갖는다. 수소 원자는 전자가 1개이기 때문에 껍질이 하나다.
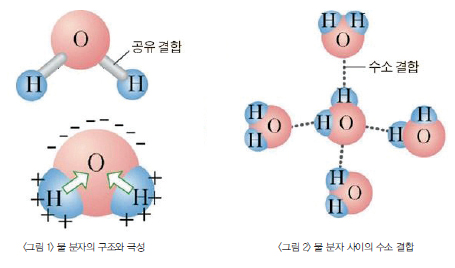
수소 원자는 첫째 껍질에 전자를 하나만 갖고 있어 한 개를 더 늘려 2개에 맞추려는 성질을 갖고 있다. 산소 원자도 둘째 껍질에 있는 6개의 전자를 8개로 만드려는 성질을 갖고 있다(이를 옥텟 규칙*이라 한다). 이를 위해 2개의 수소 원자와 산소 원자가 결합해 서로의 전자를 공유한다. 이러면 수소 원자는 산소 원자의 전자를 공유받아 첫째 껍질의 정원을 맞추게 된다. 산소 원자도 두 수소 원자의 전자를 빌려 둘째 껍질의 정원을 맞출 수 있다. 이러한 결합을 ‘공유결합’이라 한다. 물 분자는 산소 원자와 수소 원자가 공유결합한 것이다.
두 번째 단서 : 수소결합
산소 원자는 몸집이 크다. 원자핵도 8개의 전자를 거느릴 만큼 크고 강하다. 반면 수소 원자의 원자핵은 1개의 전자만 거느린다. 전자를 공유하기는 했지만 원자핵 크기 차이 때문에 그 전자들은 산소 원자에 조금 더 가까이 다가간 형태가 된다. 그래서 공유결합 내의 산소 원자는 약간의 (-)전하를, 수소 원자는 약간의 (+)전하를 띠게 된다.
물 분자가 나름의 전하를 띤 것의 결과는 또다른 물 분자를 마주 쳤을 때 나타난다. 한 물 분자 내의 산소 원자는 다른 물 분자의 수소 원자를 끌어들이게 된다. 이러한 분자 간 결합을 ‘수소결합’이라 한다. 물은 물 분자들이 수소결합해 이뤄진 것이다.
마지막 : 고무줄로 알아보는 음펨바 현상
음펨바 현상은 공유결합과 수소결합의 상호작용으로 발생한다. 물이 가열되면 분자와 분자 사이의 간격이 늘어난다. 그러면 수소결합의 간격도 길어진다. 반대로 공유결합의 간격은 줄어든다. 이 간격이 줄어들었다는 것은 에너지를 잃은 것을 뜻한다. 가열하며 공유결합의 에너지가 방출된 격이다. 반면 가열로 길어진 수소결합의 간격은 그만큼 에너지가 축적됐다는 것을 뜻한다.
이때 가열을 중단하고 냉각시키면, 공유결합은 이미 간격이 줄어들어 있고, 늘어난 수소결합은 그만큼 더욱 빠르게 수축하며 에너지를 방출한다. 빨리 얼게 되는 것이다. 공유결합과 수소결합을 고무줄이라고 생각하면 이해가 쉽다. 고무줄은 늘어날수록 탄성이 강하다. 반대로 짧아질수록 느슨해져 에너지를 잃는다. 가열로 인해 수소결합의 고무줄은 늘어났고 반대로 공유결합의 고무줄은 느슨해졌다. 가열을 중단하고 냉각하면 팽팽해진 수소결합의 고무줄은 빠르게 줄어들게 되는 것이다.
* 원자는 최외각 껍질이 완전히 채워지거나 전자 8개를 가질 때,
더 높은 에너지를 갖는 전자가 없을 때 가장 안정하다는 규칙이다.
글_ 김민기 기자 mickey@uos.ac.kr
사진_ 조선일보 출처

